Un regalo di Natale per L.U.C.A.
Caro L.U.C.A.,
Natale é già passato da quasi due settimane, ma trovo solo ora il tempo di mandarti una foto del regalo che ho deciso di farti per Natale! Come ben sai, tu sei l’ultimo antenato comune tra tutte le specie viventi, il nostro Last Universal Common Ancestor, e per questo ho deciso di regalarti un pesce! Mi prenderò cura di lui come se fosse un mio parente (anche se effettivamente lo é, perché risalendo i nostri alberi genealogici fino a 3,6/4 miliardi di anni fa dovremmo trovare entrambi te) e posterò regolarmente delle foto e dei dati sulla sua crescita.
Facendo delle ricerche sul tuo conto ho scoperto che in fondo, ma molto in fondo, ho dei legami, per quanto lontani, con tutti gli esseri viventi. Mi prenderò quindi cura non solo del pesce, a cui ho dato il nome Sushi, ma anche dell’ambiente in cui lui vivrà (sempre che vivrà, visto che, come puoi vedere dalla foto, il mio gatto lo sta già puntando) e mi preoccuperò di adattare l’acquario alle sue esigenze.
Ho infatti in programma di portare presto degli amici pesci a far compagnia a Sushi, magari prendendogli anche una nuova casa.
Nel frattempo terrò a bada il nemico!
Population Genetics: When Darwin Met Mendel
Ogni volta che visito il canale youtube crashcourse trovo sempre qualcosa di interessante!
Oggi mi sono imbattuto in un video in cui Gregor Mendel incontra Charles Darwin, con qualche accenno all’appena trattato equilibrio di Hardy-Weinberg.
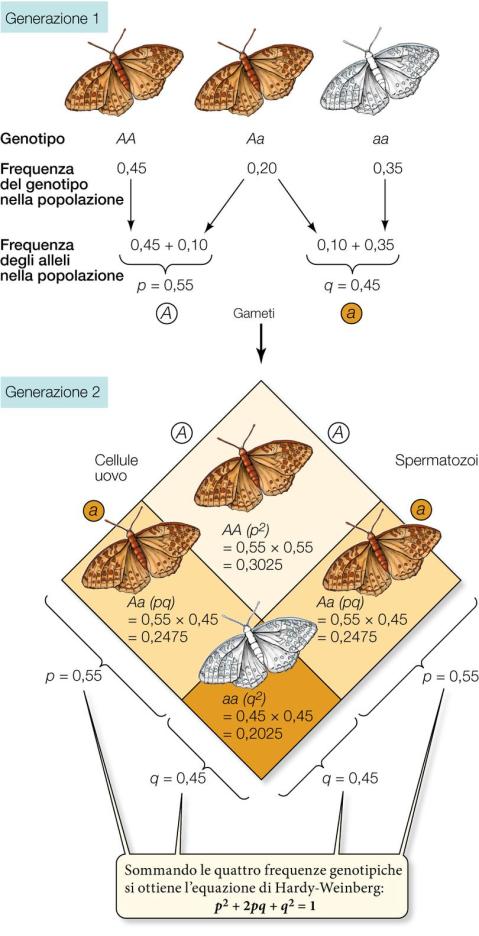
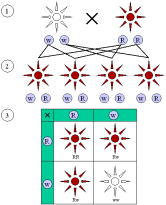
L’equilibrio di Hardy-Weinberg
Nel 1908, il matematico britannico Godfrey Hardy e il medico tedesco Wilhelm Weinberg dedussero le condizioni necessarie perché la struttura genetica di una popolazione si mantenga invariata nel tempo.
Il concetto di equilibrio di Hardy-Weinberg è la chiave di volta della genetica di popolazione. La relativa equazione descrive una situazione modello in cui le frequenze alleliche rimangono costanti da una generazione all’altra e le frequenze genotipiche sono ricavabili da quelle alleliche. La legge dell’equilibrio di Hardy-Weinberg si applica agli organismi che si riproducono sessualmente. Le condizioni che devono essere soddisfatte affinché una popolazione si trovi all’equilibrio di Hardy-Weinberg sono le seguenti:
- Gli accoppiamenti devono essere casuali.
- Gli individui non devono preferire partner con particolari genotipi.
- La popolazione deve essere di grandi dimensioni.
- Più grande è la popolazione, minore è l’effetto delle eventuali fluttuazioni casuali delle frequenze alleliche.
- Non deve esserci flusso genico.
- In altre parole, non devono verificarsi fenomeni di immigrazione o di emigrazione.
- Non devono avvenire mutazioni.
- Gli alleli non si trasformano uno nell’altro né possono comparirne di nuovi.
- La selezione naturale non deve influenzare la sopravvivenza di particolari genotipi.
- Gli individui con genotipi diversi hanno la stessa possibilità di sopravvivere.
Se queste condizioni sono idealmente soddisfatte, ne seguono due importanti conseguenze. Primo, dopo una generazione di accoppiamenti casuali, se p è la frequenza allelica di A e q è la frequenza allelica di a, le frequenze genotipiche manterranno i seguenti rapporti:
| genotipo | AA |
Aa |
aa |
| frequenza | p2 |
2pq |
q2 |
Considera la generazione 1 in cui la frequenza dell’allele A (p) è 0,55. Poiché abbiamo ipotizzato che gli individui scelgano i propri partner casualmente, senza considerare il loro genotipo, i gameti portatori dell’allele A oppure dell’allele a si combinano casualmente, cioè secondo quanto previsto dalle rispettive frequenze p e q.
Nel nostro esempio, la probabilità che un particolare gamete porti un allele A anziché a è di 0,55. In altre parole, su 100 gameti presi a caso, 55 recheranno l’allele A. Dato che q = 1 − p, la probabilità che uno spermatozoo o una cellula uovo rechi l’allele a sarà 1 − 0,55 = 0,45.
La probabilità che alla fecondazione l’incontro avvenga tra due gameti portatori di A è data dal prodotto delle due probabilità relative ai singoli eventi:
p x p = p2 = (0,55)2 = 0,3025
Quindi, nella generazione successiva, il 30,25% della prole avrà genotipo AA. Allo stesso modo, la probabilità che si incontrino due gameti portatori di a sarà
q x q = q2 = (0,45)2 = 0,2025
e il 20,25% della generazione successiva avrà genotipo aa.
La seconda conseguenza è che le frequenze p e q degli alleli di un gene rimangono costanti di generazione in generazione, come ora è facile dimostrare. Infatti nella nuova generazione della nostra popolazione ad accoppiamenti casuali la frequenza dell’allele A è p2 + pq, e sostituendo q con 1 − p, l’espressione diventa:
p2 + p (1 − p) = p2 + p – p2 = p
Le frequenze alleliche di partenza restano immutate, e la popolazione si trova all’equilibrio, espresso dall’equazione di Hardy-Weinberg:
p2+ 2pq + q2= 1
Se le frequenze genotipiche nella generazione parentale dovessero cambiare (per esempio, per l’emigrazione di un gran numero di individui AA), anche le frequenze alleliche nella generazione successiva risulterebbero alterate. Tuttavia, partendo dalle nuove frequenze alleliche, basta una sola generazione prodotta in seguito ad accoppiamenti casuali per riportare le frequenze genotipiche all’equilibrio.
(Tratto liberamente da http://ebook.scuola.zanichelli.it/sadavabiologia/l-evoluzione-dopo-darwin-la-teoria-sintetica/document-85)
Ecco anche un trattato di 12 pagine che spiega dettagliatamente LA LEGGE DI HARDY-WEINBERG
H. J. Muller
Hermann Joseph Muller scoprì che alcune radiazioni possono avere l’effetto di mutageni. Mendel aveva dimostrato che le coppie di alleli segregano indipendentemente dalle altre coppie. In realtà gli alleli di due geni differenti possono segregare indipendentemente solo se i geni sono su due cromosomi diversi. I geni che tendono a rimanere insieme perché appartenenti allo stesso cromosoma appartengono allo stesso gruppo di associazione.
Quando furono incrociati individui con il corpo marrone chiaro e le ali lunghe con i mutanti con corpo nero e ali corte, nacque una generazione F1 con le caratteristiche normali.
Dall’incrocio tra gli individui F1, si ipotizzò che o i geni per il colore del corpo e la lunghezza delle ali si sarebbero potuti segregare indipendentemente generando un rapporto 9:3:3:1, indicando che i geni per i due caratteri si trovavano su coppie differenti di cromosomi omologhi, o che i geni potevano essere associati e sarebbero nati il 75 % marrone con ali lunghe e il 25 % nero con ali corte. I risultati si avvicinarono alla seconda ipotesi ma alcuni geni segregavano indipendentemente.
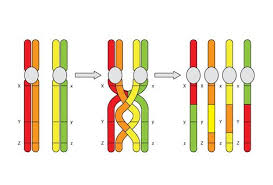
Morgan suppose che ci potesse essere uno scambio di alleli tra cromosomi omologhi, il crossing over.
“Il crossing over è l’importante meccanismo di ricombinazione del materiale genetico proveniente dai due genitori, che permette una maggiore varietà nei prodotti della riproduzione sessuata.“ (Definizione di crossing over, tratta da Wikipedia)
Thomas Hunt Morgan
Morgan fu il primo ad effettuare degli studi sui caratteri trasportati da geni portati da cromosomi legati al sesso.
Compì i suoi studi sulla Drosophila melanogaster, il moscerino della frutta che possiede solo quattro cromosomi. Quando un giorno nella colonia di moscerini dagli occhi rossi ne comparve uno con gli occhi bianchi (maschio mutante), lo fece incrociare con una femmina con occhi rossi e in tutta la generazione F1 erano presenti solo moscerini con occhi rossi, facendo supporre che il fenotipo fosse recessivo.

Morgan incrociò allora gli individui della generazione F1 tra di loro, ma non si manifestò il rapporto 3:1 tra dominante e recessivo che si attendeva. Per di più erano solo maschi gli individui con gli occhi bianchi. Morgan incrociò quindi il primo maschio occhi bianchi con una femmina della generazione F1 eterozigote.
Dai risultati ottenuti dedusse che il gene per il colore degli occhi é presente solo sul cromosoma X e che l’allele per il carattere occhi bianchi dovesse essere recessivo.
In seguito ai risultati ottenuti Morgan non solo confermò che sono i cromosomi a trasportare i geni, ma anche che alcuni geni possono essere trasportati solo da cromosomi legati al sesso (X e Y).
Walter Sutton e i cromosomi
Nel 1902 Walter Sutton stava studiando la produzione di gameti nei maschi della cavalletta, quando notò che i cromosomi risultavano appaiati sin dall’inizio della prima divisione meiotica e i due cromosomi di ogni coppia erano molto simili.
Sutton fu colpito dal parallelismo delle sue osservazioni con la legge di Mendel sulla segregazione*, ipotizzando che i geni si trovassero nei cromosomi e che i due alleli di ogni gene si trovassero su cromosomi omologhi. Supponendo inoltre che gli alleli fossero sempre indipendenti e fossero separati nella meiosi I, dedusse che, durante la fecondazione, potessero nascere nuove combinazioni di alleli.
Riguardo la terza legge di Mendel** (gli alleli di geni diversi si separano indipendentemente gli uni con gli altri) sostenne la sua valida, purché i geni non si trovassero sulla stessa coppia di cromosomi omologhi.
Il suo principale contributo alla biologia fu quindi l’aver messo in relazione l’ereditarietà con i cromosomi a livello cellulare.
*SEGREGAZIONE: ogni individuo possiede coppie di fattori per ogni unità ereditaria e i membri di una coppia si separano (segregano) nella formazione dei gameti.
**ASSORTIMENTO INDIPENDENTE: dall’incrocio di due eterozigoti della generazione F1, si ottiene una generazione F2 in cui i caratteri segregano in maniera del tutto indipendente, originando nuove combinazione che seguono proporzioni definite.
Correlazione genotipo-fenotipo
Ecco alcune definizioni che possono essere utili per ripassare gli effetti dell’interazione fra i geni sul fenotipo:
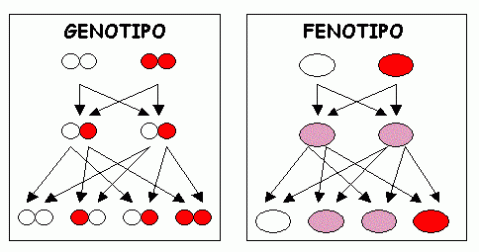
DOMINANZA INCOMPLETA: il fenotipo dell’eterozigote presenta caratteristiche intermedie tra quelle dei due omozigoti.
CODOMINANZA: organismi eterozigoti non presentano caratteristiche intermedie ma mostrano entrambi i fenotipi eterozigoti.
All’interno di una popolazione di organismi é possibile che ci siano più di due forme alleliche per uno stesso gene. Si tratta di ALLELI MULTIPLI derivanti da più mutazioni di uno stesso gene.
Le caratteristiche del fenotipo di un organismo sono per lo più derivanti dall’interazione tra due o più geni distinti; in questo caso possono apparire dei fenotipi completamente nuovi.
In altri casi possono non essere prodotti dei nuovi fenotipi, ma un gene maschera gli effetti di un altro (EPISTASI).
É detto EREDITA’ POLIGENICA quel fenomeno che coinvolge più di due geni nella determinazioni dei caratteri dell’individuo. In questo caso il carattere presenta una gradazione di lievi differenze detta variazione continua.
PLEIOTROPIA: quando un singolo gene ha molteplici effetti sul fenotipo di un organismo.
Hugo de Vries
Hugo De Vries studiò le mutazioni su una pianta di rapunzia a grandi fiori, ipotizzando che esse causassero la comparsa di nuovi caratteri del tutto assenti nelle generazioni precedenti.
Elaborò così la teoria delle mutazioni, secondo la quale ogni organismo vivente nel corso della sua storia subisce un certo numero di mutazioni che tramanda alla sua discendenza. Inizialmente questa teoria entrò in contrasto con quella darwiniana, non conciliando la lenta evoluzione ipotizzata da Charles Darwin con i cambiamenti repentini provocati dalle mutazioni osservate da de Vries, solo successivamente si riuscì a dimostrare la validità di entrambe le tesi.
De Vries è noto anche per aver riscoperto la teoria di Mendel.
Negli ultimi anni le teorie di De Vries sono state ampiamente rivisitate: ad oggi si ritiene errato parlare di mutazioni com da lui intese (macromutazioni), ma si deve piuttosto parlare di micromutazioni.
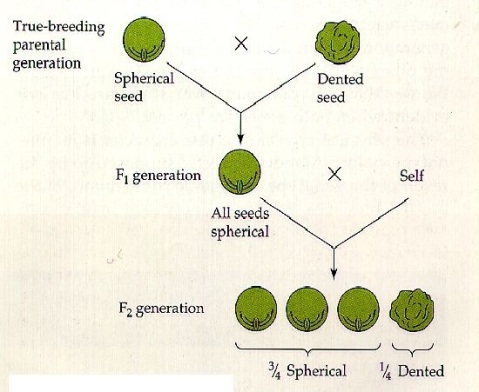
Le tre leggi di Mendel
Frate Gregor non fu solo geniale, ma anche innovativo. Per giungere alle sue straordinarie scoperte, egli organizzò il suo lavoro in modo che potesse raggiungere risultati più precisi e dati più ricchi e facilmente comprensibili.
Egli strutturò la ricerca in questo modo:
-ipotesi di lavoro;
-pianificazione ben curata e scelta di studiare solo caratteristiche ereditarie nette;
-studio dei discendenti di più generazioni;
-conteggio del numero dei discendenti e analisi dei risultati.
Questo nuovo metodo lo portò all’elaborazione delle tre leggi che stanno alla base della genetica classica.
Mendel compì i suoi studi sulle piante di pisello, delle quali aveva identificato sette linee pure.
Dopo l’incrocio tra due linee pure nacque la prima generazione F1, che presentava solo uno dei due caratteri presente nei genitori (dominante); l’altro venne chiamato recessivo.
DOMINANZA: dall’incrocio di organismi che differiscono per una coppia di caratteri si ottengono solo individui che mostrano il carattere dominante.
Mendel notò che nella seconda generazione, nata dall’incrocio tra individui della prima generazione, i caratteri dominanti si presentavano in rapporto 3:1.
SEGREGAZIONE: ogni individuo possiede coppie di fattori per ogni unità ereditaria e i membri di una coppia si separano (segregano) nella formazione dei gameti.
Incrociando infine gli eterozigoti della generazione F1, che differivano tra di loro per due o più caratteri, osservò che i fenotipi della prole si presentavano in rapporto 9:3:3:1.
ASSORTIMENTO INDIPENDENTE: dall’incrocio di due eterozigoti della generazione F1, si ottiene una generazione F2 in cui i caratteri segregano in maniera del tutto indipendente, originando nuove combinazione che seguono proporzioni definite.
Quell’imbroglione di Mendel
Non tutti sanno che il geniale frate Gregor Mendel, per divenire quello che noi ora riteniamo il padre della genetica, imbrogliò. Viste le conoscenze e gli strumenti a disposizione del naturalista in quella lontana epoca storica, si ritiene sia impossibile, o comunque alquanto improbabile, che con così pochi dati da prendere in considerazione, i risultati rispecchiassero alla perfezione la sua teoria.
Ma non concentriamoci su come arrivò alle sue leggi, bensì su come quest’ultime sono e che cosa comportano.
Ecco una dettagliata spiegazione di come si svolse il lavoro del frate agostiniano.
Le mutazioni geniche
Per mutazione genica si intende quella variazione, anche minima, che avviene nella struttura molecolare di un gene e che può riguardare un solo nucleotide, come anche più nucleotidi, della catena di DNA, come ad esempio la sostituzione di una purina o di una pirimidina con un’altra base azotata (per es.: come avviene nell’anemia falciforme si ha la sostituzione della timina con l’adenina). Una volta avvenuta questa mutazione nella struttura molecolare del materiale genico, essa si riproduce a ogni replicazione del DNA e cioè diventa ereditaria; soltanto un altro cambiamento potrà produrre una nuova mutazione che potrebbe anche consistere in un ritorno alla struttura originale.
Sono, quindi, le mutazioni che alterano un singolo gene e dunque le più “piccole” che si possono avere. In quanto tali non sono visibili attraverso analisi al microscopio (tranne alcuni casi estremi), ma possono essere riscontrate solo tramite analisi genetiche. Le mutazioni geniche portano alla formazione di nuove forme geniche, ovvero di nuovi alleli, detti appunto alleli mutanti. In quanto tali questi sono rari nella popolazione e si differenziano dagli alleli più diffusi detti invece tipi selvatici. Bisogna però far distinzione anche tra alleli mutanti e morfi. I morfi sono infatti due o più alleli di uno stesso gene con frequenza superiore all’1% (polimorfismo). Alla luce di questo ne deriva che il concetto di mutazione non è assoluto: un gene potrà subire una mutazione; se l’allele mutante però troverà le condizioni per diffondersi nella popolazione e superare la frequenza dell’1% non si parlerà più di mutazione ma di morfo.
Possono essere distinte in due categorie: mutazioni puntiformi e mutazioni per sequenze ripetute. Le prime sono causate da sostituzioni di basi o da inserzioni o delezioni di coppie di basi (mutazioni indel). La seconda categoria comprende le mutazioni causate sempre da inserzioni o delezioni ma di sequenze di basi ripetute.
Mutazioni puntiformi
Sostituzioni di basi: Determinano uno scambio di un nucleotide con un altro. Sono definite transizioni qualora vi è un scambio di una purina con altra purina (A ↔ G) o di una pirimidina con un’altra pirimidina (C ↔ T); oppure transversioni quando lo scambio è di una purina con un a pirimidina o viceversa (C/T ↔ A/G). In genere le transizioni sono più frequenti delle transversioni. Quando ci si riferisce a mutazioni di una sequenza che codifica per un determinato prodotto genico le sostituzioni potranno essere:
Mutazioni per sequenze ripetute
Analoghe alle mutazioni indel, interessano però più di un nucleotide adiacente; in particolare interessano gruppi nucleotidici che formano una sequenza la quale si ripete più volte di seguito. La mutazione, che si origina nel corso della replicazione del DNA, provoca una variazione nel numero di queste sequenze ripetute; il nuovo filamento di DNA potrà presentarne in eccesso o in difetto. Il fenomeno che causa la mutazione è detto slittamento della replicazione (replication slippage). Malattie genetiche associate a questo tipo di mutazione sono la Corea di Huntington e la sindrome dell’X fragile.
Effetti delle mutazioni geniche
Gli effetti possono essere notevolmente diversi a seconda del tipo di mutazione e della posizione in cui questa si verifica. Una mutazione può non portare a nessuna conseguenza e questo quando interessa DNA che non codifica (o meglio sembra non codificare) per nessun prodotto genico (il cosiddetto junk DNA o DNA spazzatura). Se la mutazione va invece ad alterare le sequenze codificanti, ovvero i geni, si ha una variazione nel tipo o nella quantità del corrispettivo prodotto genico, che può essere una proteina o RNA funzionale (rRNA, tRNA, snRNA ecc.). Parliamo in questo caso di mutazione biochimica; se la mutazione biochimica porta a una variazione visibile del fenotipo si parla di mutazione morfologica.
Inoltre distinguiamo, sempre in relazione agli effetti, in:
mutazione positiva: quella che porta un vantaggio evolutivo;
mutazione neutra: quella che non risulta in un depotenziamento della capacità riproduttiva dell’individuo;
mutazione subletale: quella che rende più difficoltosa la perpetuazione riproduttiva dell’individuo (il tipico esempio sono le malattie genetiche che debilitano in qualche modo l’individuo, rendendolo meno capace di riprodursi, senza però impedirglielo totalmente);
mutazione letale: quella che non permette all’individuo di raggiungere l’età riproduttiva o non gli permette di riprodursi.
L’efficacia della mutazione, sia positiva che negativa, dipende poi dal tipo di allele mutato così creato; questo potrà essere infatti dominante o recessivo. Nei diploidi (2n cromosomi) se è dominante avrà sempre effetto (sia in un eterozigote che in un omozigote dominante); se è recessivo, essendo aploinsufficiente, per avere effetto ha bisogno che anche l’altro elemento della coppia genica sia mutato (individuo omozigote recessivo). Negli aploidi , che sono emizigoti (n cromosomi), la mutazione avrà invece sempre effetto. (Fonte adattata e rielaborata: ftp://89-97-218-226.ip19.fastwebnet.it/web1/DNA/dna.htm)
Dal minuto 4.47 del video, un esempio di quotidiana mutazione genica:
La sintesi proteica
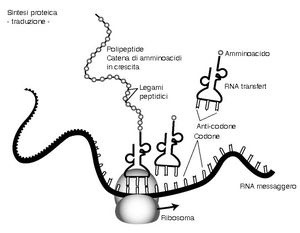
La traduzione è lo stadio della sintesi proteica in cui le istruzioni portate dall’m-RNA vengono tradotte nella sequenza corretta di amminoacidi per formare una proteina.
La traduzione ha luogo nel ribosoma (formato da r-RNA e proteine), composto da due subunità: quella piccola contiene un sito di legame per l’m-RNA; quella grande ha due siti di legame per due molecole di t-RNA e un sito che catalizza la formazione del legame peptidico tra due amminoacidi adiacenti.
Ogni molecola di t-RNA è specifica per un unico amminoacido ed è in grado di riconoscere sia l’amminoacido che deve trasportare, sia il codone complementare di m-RNA associato al ribosoma.
La traduzione ha inizio quando due codoni del filamento di m-RNA si legano alla subunità piccola di un ribosoma. Il primo codone è la tripletta di “inizio lettura” AUG, alla quale corrisponde l’amminoacido metionina; il secondo codifica il primo vero amminoacido della proteina. I due t-RNA, che hanno rispettivamente l’anticodone di inizio e l’anticodone complementare al secondo codone, si legano alla subunità grande e si forma un legame peptidico (cioè il legame tra amminoacidi che forma le proteine) tra i due amminoacidi trasportati.
Il t-RNA di inizio si stacca dal ribosoma mentre il dipeptide (i due amminoacidi uniti dal legame peptidico) rimane legato al secondo t-RNA. Il ribosoma si sposta sopra un altro codone dell’m-RNA e una nuova molecola di t-RNA con il proprio amminoacido si dispone nel sito di legame vuoto del ribosoma. Si crea un nuovo legame peptidico e il tripeptide si salda all’ultimo t-RNA. Il processo di allungamento della catena polipeptidica prosegue in questo modo finché tutte le triplette sono state tradotte e viene raggiunto il codone di “fine lettura”. La proteina completa si stacca dal ribosoma e specifici enzimi scindono il legame con la metionina.
Ecco inoltre un video esemplificativo dell’argomento trattato:
Il codice genetico
Come ben sappiamo ogni cromosoma é formato sia da proteine che da DNA. Ogni proteina contiene 20 amminoacidi differenti, ma il DNA e l’RNA, fonti del codice genetico delle proteine, contengono solo quattro basi azotate. Come é possibile?
Se ciascun nucleotide codificasse per un amminoacido, alle quattro basi corrisponderebbero solo quattro amminoacidi. Analogamente, se un amminoacido fosse codificato da due nucleotidi ci sarebbero al massimo 16 amminoacidi, comunque non sufficienti. Per ottenere un numero più che sufficiente di combinazioni, ogni amminoacido deve essere quindi codificato da tre nucleotidi, per un totale di 64 amminoacidi. Ogni combinazione é quindi costituita da una sequenza di tre nucleotidi chiamata codone.
Di queste 64 combinazioni, 3 rappresentano segnali di arresto (UUA, UAG e UGA) e le restanti 61 dei veri e propri amminoacidi, corrispondenti ai soli 20 presenti nella proteina. Ciò é possibile poiché i codoni ai quali corrisponde uno stesso amminoacido differiscono spesso solo per il terzo nucleotide ed é per questo che il codice viene definito degenerato.
Un simpatico processo chiamato Splicing
Molti geni negli eucarioti superiori codificano per RNA che possono essere tagliati in modi diversi (persino migliaia come in Drosophila) per generare due o più RNA differenti e, di conseguenza, diversi prodotti proteici in un processo detto appunto splicing alternativo. Difatti, oltre alla scelta di esoni alternativi, alcuni esoni possono essere estesi ed altri addirittura saltati (di proposito). Inoltre, alcuni introni possono essere mantenuti, anziché eliminati, e dar luogo perciò a prodotti proteici ancora differenti. Di conseguenza, si può dire che lo splicing alternativo può essere sia costitutivo, sia regolato. Nel primo caso, più di un prodotto viene sempre generato dal gene trascritto. Nel caso dello splicing regolato, forme diverse vengono generate in momenti diversi, in diverse condizioni o in diversi tipi cellulari o tessuti. Comunque, le proteine che regolano lo splicing si legano a dei siti specifici chiamati enhancer o silenziatori di splicing esonici o intronici (exonic – intronic – splicing enhancers o silencers, ESE o ISE – ESS o ISS). I primi incrementano mentre i secondi reprimono lo splicing sui siti di splicing vicini. Abbiamo già incontrato gli enhancer e le proteine SR che si legano ad essi, portando il macchinario di splicing su diversi siti. Perciò, la presenza o l’attività di una data proteina SR può determinare quale sito particolare di splicing venga utilizzato in un determinato tipo cellulare o in un particolare momento dello sviluppo. La maggior parte dei silenziatori, invece, vengono riconosciuti dai membri della famiglia delle ribonucleoproteine nucleari eterogenee (hnRNP, heterogeneous nuclear ribonucleoprotein). Quest’ultime legano l’RNA ma non hanno nessun dominio che riesca a far reclutare il macchinario di splicing e quindi impediscono l’utilizzo di siti specifici di splicing. Un altro repressore dell’ splicing di mammifero è la proteina hnRNP, che blocca il legame del macchinario di splicing attraverso il suo legame con la regione polipirimidinica. In generale, si considera lo splicing alternativo come un modo per produrre proteine diverse da un singolo gene. Queste proteine diverse sono chiamate isoforme. Possono avere funzioni simili, funzioni distinte e persino funzioni antagoniste. Ma anche alcuni geni che codificano per una sola proteina funzionante subiscono uno splicing alternativo. In questi casi, questo meccanismo viene usato semplicemente per spegnere o accendere l’espressione del gene. Infatti, lo splicing alternativo, in quest’ultimo caso determina se l’esone con il codone di stop venga incorporato nell’mRNA e, di conseguenza, se il gene venga espresso o no. La seconda maniera in cui lo splicing alternativo viene usato per l’accensione o lo spegnimento di un gene è attraverso la regolazione dell’utilizzo di un introne, il quale, se mantenuto nell’mRNA, impedisce all’mRNA stesso di essere esportato dal nucleo e perciò tradotto. (Tratto da tesionline.it)
RNA: il processo di trascrizione
Le molecole di mRNA sono assemblate partendo da un filamento di DNA, in base allo stesso principio di appaiamento delle basi azotate che regola la duplicazione del DNA. Questo processo di sintesi dell’RNA è definito “trascrizione” e ha la funzione di trascrivere il messaggio contenuto di un frammento di DNA in un trascritto di RNA.
I siti di legame per la RNA polimerasi sono detti promotori e si trovano sul filamento di DNA da trascrivere, come anche le sequenze d’arresto, sequenze nucleotidiche che bloccano la sintesi dell’RNA.
L’mRNA è una molecola che ha il compito di trasportare le informazioni del DNA all’interno del citoplasma.
Il Processo di trascrizione è composto da tre fasi:
-inizio: l’RNA polimerasi riconosce il promotore e si attacca ad esso;
-allungamento: l’RNA polimerasi sintetizza il trascritto di mRNA, partendo da un filamento di DNA detto filamento stampo;
-terminazione. l’RNA polimerasi si incontra con la sequenza di arresto e il processo di trascrizione termina.
DNA, Hot Pockets, & The Longest Word Ever
Sempre dal canale youtube crashcourse, ecco un fantastico video (in inglese e con i sottotitoli in inglese) che riassume in 18 minuti tutto quello che abbiamo fatto in biologia nel corso delle ultime settimane!
Dalla trascrizione del DNA alla struttura delle proteine, passando per la parola più lunga del mondo: il nome di una proteina!
Per comodità sono qui sotto elencati gli argomenti trattati nel video:
1) Transcription 2:12
A) Transcription Unit 3:00
B) Promoter 3:10
C) TATA Box 3:32
D) RNA Polymerase 4:12
E) mRNA 4:15
F) Termination signal 5:21
G) 5′ Cap & Poly-A Tail 5:34
2) RNA Splicing 6:08
A) SNuRPs & Spliceosome 6:26
B) Exons & Introns 6:56
3) Translation 7:28
A) mRNA & tRNA 8:01
B) Triplet Codons & Anticodons 8:39
4) Folding & Protein Structure 10:51
A) Primary Structure 11:11
B) Secondary Structure 11:23
C) Tertiary Structure 11:58
D) Quaternary Structure 12:44
PCR- Reazione a catena della polimerasi
La reazione a catena della polimerasi è una tecnica che consente la moltiplicazione di frammenti di DNA dei quali si conoscano le sequenze nucleotidiche iniziali e terminali. L’amplificazione mediante PCR consente di ottenere molto rapidamente la quantità di materiale genetico necessaria per le successive applicazioni. La PCR viene utilizzata in tutte quelle situazioni in cui bisogna amplificare un quantitativo di DNA fino a livelli utili per analisi successive. I campi di applicazione sono enormi. La tecnica viene sfruttata, per esempio, in medicina per la diagnostica microbiologica o per l’evidenziazione di cellule tumorali, in tumori liquidi, quando esse sono troppo poche per essere evidenziate da altre metodiche (malattia minima residua). Estremamente utile è l’uso della PCR in medicina legale. In biologia la PCR viene usata per le analisi di paleontologia e di antropologia molecolare ed in numerosi campi dell’ingegneria genetica. (Definizione adattata da Wikipedia)
Ecco come funziona la PCR, con una breve introduzione sulla struttura del DNA che termina al minuto 2.34:
Il Proofreading
Nel processo di duplicazione del DNA non sono assenti errori, che, se non corretti, potrebbero portare a gravi conseguenze. Per nostra fortuna esiste il proofreading, quel processo che consente il riconoscimento e la correzione di errori nel DNA.
Durante la replicazione, un gruppo di enzimi tiene costantemente sotto controllo la doppia elica del DNA e quando incontra un errore (errato accoppiamento di nucleotidi o basi azotate) può operare in diversi modi:
-RIPARAZIONE DIRETTA: l’enzima riconosce l’errore nel DNA e lo corregge direttamente;
-RIPARAZIONE PER TAGLIO DI BASI/NUCLEOTIDI: la porzione di filamento con una base o un nucleotide sbagliato viene rimossa, il filamento di DNA complementare viene usato come stampo per sintetizzare la nuova porzione corretta;
RIPARAZIONE DI UN APPAIAMENTO ERRATO: questo sistema è simile al precedente, ma l’errore è nell’appaiamento delle basi; quando l’errore viene riconosciuto, la porzione è rimossa e il filamento di DNA complementare viene usato come stampo per sintetizzare la nuova porzione corretta.
Definizione dei metodi di riparazione liberamente tratta dal libro di testo “Invito alla biologia.blu, Zanichelli”
La duplicazione del DNA
Una delle caratteristiche fondamentali del materiale genetico é quella di produrre copie identiche di se stesso. Ciò è possibile grazie alla struttura a doppia elica del DNA, ma come funziona questa autoriproduzione?
Il sito liceogalileogalilei.it ci fornisce una semplice presentazione per incominciare a capire come funziona questo complicato processo.
Per chi ha maggiore sete di sapere, ecco altre utili fonti per lo studio:
Quest’altro video é invece molto chiaro e ben fatto, se non fosse per la voce robotica che spiega il processo:
Questo filmato, della durata di quasi mezz’ora, é più completo e complicato, per chi vuole approfondire ancora di più sull’argomento:
La struttura del DNA e del RNA
Dal sito della DeAGOSTINI sapere.it, ecco un utile riassunto delle nozioni riguardante la struttura del DNA e del RNA.